国家药品监督管理局近日通报,在飞行检查中发现,长春长生生物科技有限责任公司的冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》的行为。这是该企业继去年10月被发现一批次百白破疫苗效价指标不符合标准规定之后,在不到一年的时间里,再次出现严重违规行为。7月21日,一篇名为《疫苗之王》的文章迅速在微信朋友圈引爆,关注度已超百万,这篇文章把疫苗安全问题推到风口浪尖,民众愤怒、恐慌的情绪不断蔓延。围绕“造假”疫苗流向、涉事企业、“造假”疫苗产生影响,拷问医药监管体制、是否存在利益腐败等相关舆情进行散播。
“疫苗事件”舆情解读
一、事件概述
国家药品监督管理局近日通报,在飞行检查中发现,长春长生生物科技有限责任公司的冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》的行为。这是该企业继去年10月被发现一批次百白破疫苗效价指标不符合标准规定之后,在不到一年的时间里,再次出现严重违规行为。7月21日,一篇名为《疫苗之王》的文章迅速在微信朋友圈引爆,关注度已超百万,这篇文章把疫苗安全问题推到风口浪尖,民众愤怒、恐慌的情绪不断蔓延。围绕“造假”疫苗流向、涉事企业、“造假”疫苗产生影响,拷问医药监管体制、是否存在利益腐败等相关舆情进行散播。
7月22日晚,李克强就疫苗事件作出批示:必须给全国人民一个明明白白的交代。7月23日,习近平主席作出批示:一查到底严肃问责。坚决守住安全底线。截至目前,该事件舆情仍在快速发酵。
二、事件脉络
| 时间 | 事件 |
| 2018年7月11日之前 | 长生生物内部生产车间老员工实名举报信送达国家食品药品监督管理局。 |
| 2018年7月15日 | 国家药监局发布通告,长春长生生物科技有限责任公司在冻干人用狂犬病疫苗生产过程中存在记录造假,违反《药品生产质量管理规范》,责成吉林省食品药品监督管理局收回长春长生相关证书。通告称,所有涉事批次产品尚未出厂和上市销售。 |
| 2018年7月16日 | 长生生物(长生生物母公司)发布公告,表示正对有效期内所有批次的冻干人用狂犬病疫苗全部实施召回,称近几年监测未发现因产品质量问题引起的不良反应。 |
| 2018年7月16日 | 李克强总理就疫苗事件作出批示,要求彻查。 |
| 2018年7月17日 | 长春长生发布公告称已收到《吉林省食品药品监督管理局行政处罚决定书》,决定书针对长春长生此前生产的“吸附无细胞百白破联合疫苗”违规作出处罚。 |
| 2018年7月22日 | 李克强总理就疫苗事件再次作出批示。 |
| 2018年7月23日 | 截至16时,已有20多个省区市的疾控部门就长春长生疫苗事件回应。 |
| 2018年7月23日 | 习近平对吉林长春长生生物疫苗案件作出重要指示。 |
| 2018年7月23日 | 吉林省委召开会议:长生疫苗案件性质恶劣 从严查处。 |
| 2018年7月24日 | 吉林省纪委监委启动对长春长生生物疫苗案件腐败问题调查追责 |
三、相关部门回应
(一)全国多地相关部门回应
【国家药监局:已责令企业停止生产 对企业立案调查】
7月15日,国家药监局发布了《关于长春长生生物科技有限责任公司违法违规生产冻干人用狂犬病疫苗的通告》,国家药监局已责令企业停止生产,收回药品GMP证书,召回尚未使用的狂犬病疫苗,所有涉事批次产品尚未出厂和上市销售。
【李克强就疫苗事件作出批示:必须给全国人民一个明明白白的交代】
7月22日,李克强总理就疫苗事件作出批示:此次疫苗事件突破人的道德底线,必须给全国人民一个明明白白的交代。李克强在批示中要求,国务院要立刻派出调查组,对所有疫苗生产、销售等全流程全链条进行彻查,尽快查清事实真相,不论涉及到哪些企业、哪些人都坚决严惩不贷、绝不姑息。对一切危害人民生命安全的违法犯罪行为坚决重拳打击,对不法分子坚决依法严惩,对监管失职渎职行为坚决严厉问责。尽早还人民群众一个安全、放心、可信任的生活环境。
此前7月16日,李克强已就疫苗事件作出批示,要求彻查。
【习近平对疫苗案件作出重要指示:一查到底严肃问责 坚决守住安全底线】
7月23日,正在国外访问的中共中央总书记、国家主席、中央军委主席习近平对吉林长春长生生物疫苗案件作出重要指示指出,长春长生生物科技有限责任公司违法违规生产疫苗行为,性质恶劣,令人触目惊心。有关地方和部门要高度重视,立即调查事实真相,一查到底,严肃问责,依法从严处理。要及时公布调查进展,切实回应群众关切。
【各省疾病预防控制中心回应“疫苗事件”】
山东省疾控中心:长生生物狂犬疫苗已全部停用
山东省疾控中心消息,长春长生公司销往山东省的不合格百白破疫苗共计252600支,占全省年使用量的3.96%,流向济南、淄博、烟台、济宁、泰安、威海、日照、莱芜等8个市。这批疫苗已接种247359支,损耗、封存5241支,涉及儿童215184人,儿童接种信息在预防接种单位均有详细登记。涉及儿童未发现疑似预防接种异常反应增高。
河北省疾控中心:已全面停用封存长生生物狂犬疫苗
河北省疾控中心免疫规划管理所所长张振国介绍,长春长生生产的狂犬疫苗在河北省的采购目录之内,目前全省各地疾控机构已经全面停用并封存该企业生产的狂犬疫苗。
7月23日,河北疾控中心在官网发布消息称,针对武汉生物制品研究所有限责任公司生产的效价不合格的吸附无细胞百白破联合疫苗销往河北省的情况,经认真核查,流向石家庄、廊坊和定州三市,共有143941人使用了不合格疫苗。
重庆市疾控中心:已停止使用长生生物问题疫苗
重庆时报记者从重庆疾控中心了解到,重庆市已停止使用长春长生生物的冻干人用狂犬疫苗。已接种长春长生的狂犬病疫苗且尚未完成程序,可使用另一品牌的人用狂犬病疫苗继续按原程序完成全程接种。目前该市人用狂犬病疫苗供应充足,具体接种地点请与当地疾控中心联系。
北京市疾控中心:未招标采购过两种问题疫苗
7月22日,北京日报记者从北京市疾控中心获悉,对于长生生物两个出问题的疫苗,北京市均未采购,公众可以放心接种疫苗。
上海市疾控中心:已全面停用长生生物狂犬病疫苗
据“上海疾控”微信公众平台消息,目前,上海已全面停用长春长生生产的狂犬病疫苗。进一步的消息,需等待国家药监部门和疫苗生产企业的后续通知。如已接种过长春长生狂犬病疫苗部分剂次,可选择同样采用“五针法”的其他品牌狂犬病疫苗,按照0天,3天,7天,14天,28天各接种1剂疫苗的程序,完成后续剂次接种。
广东、浙江、福建、天津、山西、海南、四川、河南、山西、江苏、广西、甘肃、江西、湖南、西藏、青海等多省市相继回应各地疫苗情况……
【吉林省委召开会议:长生疫苗案件性质恶劣 从严查处】
7月23日,吉林省委召开会议,会议指出坚决贯彻落实习近平总书记重要指示精神和日前李克强总理批示要求,进一步增强做好长生疫苗案件查处工作的责任感和紧迫感,以最坚决的态度和有力的举措,全力做好案件查处工作,一查到底,坚决问责,全力保障群众切身利益和社会安全稳定大局。
【吉林省纪委监委启动对长春长生生物疫苗案件腐败问题调查追责】
目前,吉林省纪委监委已采取三项措施抓紧工作:一是对反映长春长生生物科技股份有限公司及其主要负责人的问题线索和信访举报进行梳理和调度。二是责成驻省食药监局纪检组、长春市纪委监委在查清事实基础上,厘清责任,对省市食药监部门相关责任人失职渎职问题,依纪依法严肃查处问责。三是成立责任追究工作组,对长春长生生物科技股份有限公司改制、生产、经营过程中可能存在的腐败问题进行调查追责。
(二)安徽省相关部门回应
【省级部门回应】
7月23日上午,安徽省疾病预防控制中心发布了关于近期疫苗相关问题解答。目前安徽省境内已全部停用长春长生公司狂犬疫苗,对已经接种了长春长生狂犬疫苗部分针次但尚未完成全程的接种者,按照国家药监局和国家卫生健康委员会疾控局公开发布的信息以及国家《狂犬病暴露预防处置工作规范》要求,可使用另外品牌的狂犬病疫苗按照原接种程序完成后续接种。根据2017年11月3日国家食品药品监管总局发布信息:长春长生生物科技有限公司生产的批号为201605014-01、武汉生物制品研究所有限责任公司生产的批号为201607050-2的百白破疫苗效价指标不符合标准规定,我省未采购上述批次百白破疫苗,上述批次百白破疫苗未流入我省。
安徽省食药监:安徽已封存长生生物4个批次12000支狂犬病疫苗
7月23日,记者从省食药监局获悉,安徽承担长生生物配送业务的企业,已按要求对在库尚未配送4个批次12000支的冻干人用狂犬病疫苗进行了封存,安徽省已全面停止配送长春长生生物科技有限责任公司生产的冻干人用狂犬病疫苗。
据悉,长生生物疫苗事件后,省食药监第一时间对安徽省承担长春长生生物科技有限责任公司冻干人用狂犬病疫苗配送业务的安徽瑞源公司进行了监督检查。企业按要求对在库尚未配送4个批次12000支的冻干人用狂犬病疫苗进行了封存。按照国家药监局公告,所有涉事批次产品尚未出厂和上市销售。安徽省已全面停止配送长春长生生物科技有限责任公司生产的冻干人用狂犬病疫苗。
【各地市相关回应】
2018年7月16日,市卫计委通知市疾控中心调查了解长春长生狂犬病疫苗在我市影响范围;同时立即通知镜湖区、三山区、芜湖县采购替代疫苗,确保替代疫苗储备充足;截止到目前,尚剩余3659支,现有疫苗已全部停用封存,替代疫苗已全部采购到位,储备充足。
2018年7月18日,记者从铜陵市疾控中心了解到,我市目前使用的狂犬疫苗主要为辽宁产,涉事企业狂犬疫苗产品未出现在铜陵地区。据了解,我市疾控中心、义安区疾控中心近年来使用的狂犬疫苗均为辽宁成大生物股份公司生产,枞阳县疾控中心使用的是广州诺诚和辽宁成大两个品牌,涉事疫苗品牌在铜陵地区没有使用。
安庆:安庆市疾病预防控制中心:关于目前百白破疫苗问题答疑解惑
2018年7月23日,安庆市疾病预防控制中心官网发布公开信息,关于目前百白破疫苗问题答疑解惑,提及效价指标不合格的百白破疫苗涉及哪些企业和批号,儿童接种后有何影响等问题进行解答。
淮北市疾病预防控制中心表示今天上午,安徽省疾病预防控制中心发布了关于近期疫苗相关问题解答。上述批次百白破疫苗未流入安徽,我市也没有。
日前,淮南市启动了为期4个月的疫苗储存和运输管理规范执行情况监督检查。本次专项监督检查,范围包括全市范围内的疾病预防控制机构及预防接种单位。
合肥、宣城、亳州、阜阳、黄山等其他地市均对问题疫苗进行回应。
四、舆情概况
疫苗事件在互联网舆论场中呈现高热态势,目前仍处于舆情高涨期。基于政安-互联网和记平台登录评估系统,截至7月24日13:00,共搜索到“长生生物疫苗事件”相关信息330余万条,其中网站新闻报道51849条,论坛36597条,微博信息3111097条,微信公众号信息50644篇,客户端信息39928篇, 博客4604篇、政务网站2156篇,报刊信息2049篇,视频信息1694条,外媒数据218条。
(一)舆情时间走势
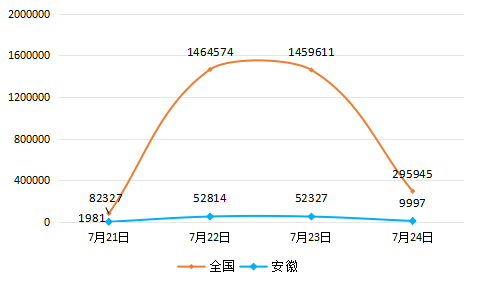
舆情发展期(7月15日至7月21日)
7月15日,国家药监局称,近期查获一批生产记录造假的狂犬疫苗,长春长生生物科技有限责任公司的冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为。国家药监局已要求吉林省食品药品监督管理局收回长春长生《药品GMP证书》,责令停止狂犬疫苗的生产,对相关违法违规行为立案调查。
7月18日一早,长生生物发布公告称,由于公司对有效期内所有批次的冻干人用狂犬病疫苗全部实施召回
然而一波未平,一波又起。7月19日晚,长生生物发布公告,称其全资子公司长春长生生物科技有限公司(简称“长春长生”)收到《吉林省食品药品监督管理局行政处罚决定书》,原因是该公司生产的“吸附无细胞百白破联合疫苗”(批号:201605014-01),经食品药品检定研究院检验,检验结果“效价测定”项不符合规定。
两起疫苗事件发生后,长生生物迅速成为舆论的焦点,针对此事件,媒体和网友的关注的话题主要在:问题疫苗的流向、监管部门不作为、涉事企业处罚过轻、国产疫苗安全性受质疑等。
舆情爆发期(7月21日以后至今)
7月21日,网友“兽爷”在微信公众号—售楼处推送了一篇《疫苗之王》的文章,席卷微信朋友圈,关注度超百万,将疫苗安全问题推至风口浪尖。《疫苗之王》提到,韩刚君和杜伟民等人当年以较低的价格从国有股东手里购买到疫苗公司股权,一家问题频出的企业,却在金融市场牟取暴利,所向披靡,一路高歌,种种细节让人唏嘘。
7月22日午间,人民日报发表两篇评论,《一查到底,方可纾解疫苗焦虑》以及《面对疫苗乱象,监管部门应有所作为》,对疫苗事件做出了正面回应,提倡有关部门将此次事件视为改革的契机,强化事前事中事后的全链条监管,形成疫苗安全管理的长效机制。
同时,新京报的《疫苗之王呼风唤雨,是对公众的无情嘲讽》则呼吁有关部门深入调查在资本市场一路奏凯的涉事企业。
7月22日晚间,中国政府网发文称,李克强总理就疫苗事件作出批示:此次疫苗事件突破人的道德底线,必须给全国人民一个明明白白的交代。李克强在批示中要求,国务院要立刻派出调查组,对所有疫苗生产、销售等全流程全链条进行彻查,尽快查清事实真相,不论涉及到哪些企业、哪些人都坚决严惩不贷、绝不姑息。
7月23日,正在国外访问的中共中央总书记习近平对吉林长春长生生物疫苗案件作出重要指示指出,长春长生生物科技有限责任公司违法违规生产疫苗行为,性质恶劣,令人触目惊心。有关地方和部门要高度重视,立即调查事实真相,一查到底,严肃问责,依法从严处理。要及时公布调查进展,切实回应群众关切。
随着《疫苗之王》一文的转发传播,公众对疫苗事件的恐慌、愤怒情绪迅速蔓延。有公众对国产疫苗的安全性产生普遍怀疑,刚刚从两年前“过期疫苗”案中缓慢恢复的信任似乎又要重回谷底;有自媒体顺藤摸瓜,挖掘出长春长生、武汉生物、北京民海三家疫苗生产企业之间的疑似关联,很多人“细思恐极”;有人已经对疫苗本身产生不信任感,对接种疫苗有了排斥情绪。种种舆情不断冒出,真相和谣言齐飞,公众在这些信息中愤怒、恐惧、迷失,很多人甚至怀疑,这其中是否还有不可告人的利益链条。
(二)媒体类型分布
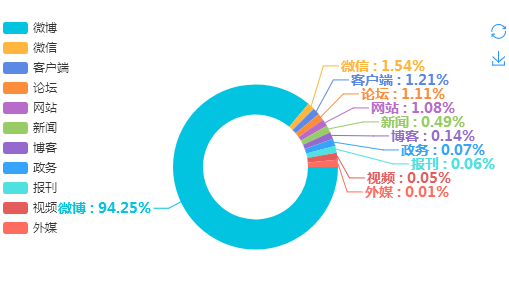
从媒体类型分布情况来看,此事虽由微信传播开来,但新浪博微成为疫苗舆情发展的主要场域。其次是微信信息和客户端信息数量,也占比较高。此外,境外媒体对此事也投入较多关注。
(三)媒体来源分布
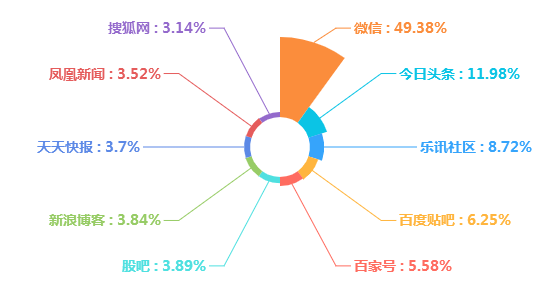
从媒体来源分布情况看,在此事件中,除双微以外,今日头条发布数量较高,其次是乐讯社区和百度贴吧。
(四)情感倾向分布
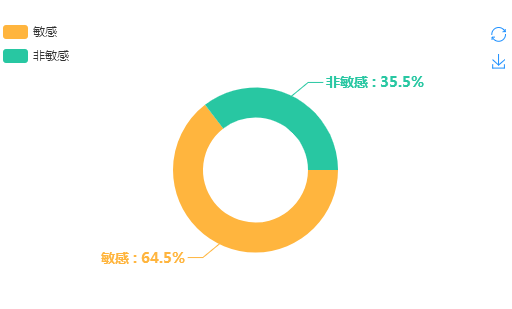
2018年7月21日至今,共监测到“长生疫苗”舆情信息330余万条,非敏感信息约占比35.5%,非敏感信息主要集中在网站新闻上,内容主要是对疫苗的情况回应、疫苗科普等方面;敏感信息约占比64.5%,集中在社交媒体中。
(五)舆情地域分布
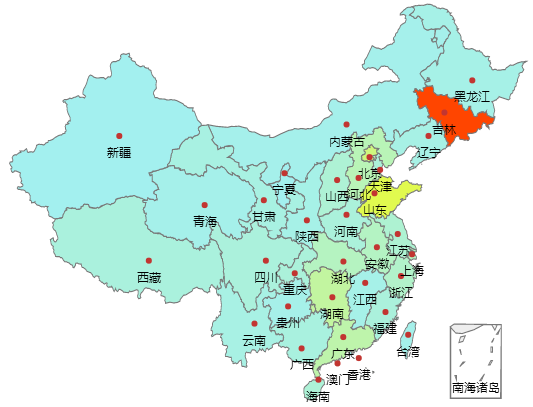
在“长生生物疫苗事件”地域舆情的分布中,舆情热度最高的省份是吉林省,地域舆情呈现红色高亮显示。其次是山东省,地域舆情呈现黄色显示。吉林作为长生生物疫苗生产的所在地,对疫苗事件非常敏感;而问题疫苗主要流向山东,因此山东对“疫苗事件”关注度也比较高。
五、公共舆论情况
(一)网民舆论
按照网民跟帖评论的内容,可将其分为恐慌焦虑、痛心愤怒、关心善后、严厉问责等类型。表现出恐慌焦虑的网民大多是发现孩子接种了问题疫苗,以致担忧会对孩子身体产生不利影响。痛心愤怒类主要是对本次“造假”疫苗涉事企业丧失良知行为的愤怒,甚至对国产疫苗的信任也几乎降至冰点。关心善后类呼吁有关部门尽快出台善后措施,积极预防此类事件再次发生。严厉问责类不仅要求对涉事企业相关责任人进行判刑等处罚外,还呼吁一查到顶加强监管,对药品安全隐患零容忍。总体来看,网民对此事件主要以负面情绪为主,主要态度情感倾向如下:
1、对“造假”疫苗表示恐慌,失信于国产疫苗
@一个有点理想的记者:为了平安的生活在这片土地上,我们已经学了太多的防骗知识。但对疫苗我们真的无能为力。这个闷热的夏天,因为发生了一些事,让人觉得比严冬还冷。
@王小早:积累口碑和信心可能需要数十年,毁了它一次就够了。至今不信任国产奶粉,希望疫苗不要重蹈覆辙。
2、对“造假”疫苗涉事企业表示愤怒,希望得到严惩
@胡锡进:支持政府严查长春长生公司,包括可能存在的官商勾结腐败线索,严惩所有贪赃枉法者。疫苗事件令人焦虑愤慨,但整个国家没少数人极力宣扬的那么烂。极少数人的人心我看才是烂透了。
@杨小giser :曝光三鹿的记者惨死,负责三鹿的官员高升,三观还未形成就被摧毁。希望国家保护好自己的英雄,也不要放过助纣为虐的渣滓。
3、关心受害者善后问题,预防此类事件再次发生
@罗昌平:关于长生生物百白破疫苗,我们更加关心的是:涉事厂商其他批次疫苗安全性如何?具体善后措施有哪些?是否执行到位?如何预防下次发生?违规企业会接受怎样的严惩?
@东北人在东莞2016:追责的同时,不要忘了善后工作。那些已经注射过疫苗的孩子们,需要重新做个抗体检测,有必要的免费重新接种疫苗。焦点不能搞虚了,善后和追责两手抓。天天喊着追责,几十万孩子的问题也得管。
4、希望中央高度重视,加强监管严厉彻查
@MU-杰:国家的监管在哪里?简简单单的300W的处罚真的有效果吗?虽然这次疫苗是假的,对孩子没有生命没什么危害,但是如果因为没有接种上,得了类似的病,到时候遭罪的还是孩子啊,监管部门真的该好好管一下了!
@趙氏業筠:疫苗罪行,令人发指!我们每个人换位想想,要是自己的孩子接种了这样疫苗的心情感受。所以呼吁:政府拿出切实补救措施,严惩造假者—这是民族的刽子手、国家害虫!严惩放行的官员!严惩受贿的医药系统的蛀虫!
(二)媒体主要评论
1、境内媒体
(1)围绕“造假”疫苗的相关舆情
狂犬病疫苗被曝造假,涉事疫苗未流入市场。有媒体报道,日前国家药品监督管理局发布通告指出,长春长生生物冻干人用狂犬病疫苗生产存在记录造假等行为,多地已公开表示停用,涉事疫苗未流入市场。
然而,百白破“造假”疫苗流入山东,21万余儿童已接种。相关报道称,吉林省食药监局的《处罚决定书》中提到“经查明,该批药品生产数量共253338支,销售到山东省疾病预防控制中心252600支,现库存186支。”;目前,流入山东不合格百白破疫苗流向已全部查明,流向济南、淄博、烟台等8个市。这批疫苗已接种247359支,涉及儿童21万余人,后续补种工作陆续开展。
多地就“造假”疫苗作出回应,总理作出相关批示。北京、湖南、河南、上海等地对“造假”疫苗做出回应并实施召回等措施。7月22日深夜,李克强总理就疫苗事件作出批示:此次疫苗事件突破人的道德底线,必须给全国人民一个明明白白的交代。
(2)涉及长生生物企业疫苗、市值及董事长的相关舆情
长生生物疫苗“造假”不断,是否有所隐瞒?两起“造假”疫苗发生后,有媒体对其他疫苗品质提出担忧。相关典型报道有:“长生生物的疫苗造假流通链条上虱虫丛生造假不断,6年销售上亿支”;“生产和检验记录上造假,随意变更生产工艺和设备,这反映的是生产质量和管理问题,而这不可能仅仅是个别现象”;“当公司涉嫌违法违规被调查,公司理应进行说明,但长生生物三天后才打破沈默,披露处罚事项”。
疫苗“造假”已致市值蒸发近百亿,董事长高俊芳身兼四职。疫苗“造假”事件爆发后,长生生物科技企业被媒体关注。典型报道有:“长春长生是上市公司长春高新的核心资产,第一盈利大户,经历了国企改制,演变成高俊芳与丈夫张友奎、儿子张洺豪共同掌控的家族企业,高俊芳身兼四职”;“事件发生后,长生生物股价已经连续5个一字板跌停,市值蒸发近百亿”。
(3)问责“造假”疫苗的相关舆情
官媒痛批“造假”疫苗,道歉罚款即可免责?长生生物“造假”疫苗事件持续发酵,人民日报、光明日报、央视网等五家官媒相继就该事件发表评论,主要指向对涉事企业的问责。典型观点有:“疫苗事关生命健康,质量安全容不得半点瑕疵,不能有一点侥幸,再次提醒相关机构加强监管、提醒相关企业不要触碰“红线”。”;“在事故抑或隐患面前,依法追责既是惩罚,也是警示。尽管这起疫苗记录造假,没有“对人体健康造成严重危害”,或不能追究刑事责任,但也少不了行政责任。”;“虽然针对生产记录造假已对长春长生进行了行政处罚,但也不能排除该企业有构成刑事犯罪的可能性”。
为何时隔近9个月才公布处罚决定?处罚是否过轻?针对“造假”疫苗事件,媒体进一步追问监管部门。典型观点有:“事发后,吉林省食药监局在官网公开了“百白破”疫苗旧案处罚决定书,这一决定的作出,距离旧案立案,已过近9个月之久;而距离狂犬病疫苗事发,仅过了三天。这样的时间安排是出于怎样的考虑?”;“长生生物被罚344万元,该罚款力度并不能达到震慑目的,违规成本太低,应提高行政处罚的上限,更要加大刑事责任追求力度”。
(4)关于拷问医药监管体制、如何平息公众恐慌的相关舆情
“造假”疫苗拷问医药监管体制,监管为何频频失守?从两年前震惊全国的山东疫苗案,到去年的长春“百白破”案,再到如今疫苗问题的再度发酵,媒体纷纷质疑是否存在监管缺位问题:“在疫苗的生产、销售过程中,是不是还存在监管漏洞?如何强化事前事中事后的全链条监管,形成疫苗安全管理的长效机制?如何加强处罚力度,让企业不想、不能、不敢有违法行为?不仅要严肃追责涉事药企,更要规范市场秩序、完善监管制度,避免类似事件再次上演。”;“疫苗事件频发预示安全警钟屡屡敲响,药品监管部门应一查到底,该问责的问责,该整改的整改,把药品隐患扼杀于萌芽阶段”。
主动回应一查到底,方可缓解公众恐慌。“造假”疫苗的爆发再次促动公众的敏感神经,真相飘在风中,讨论遍地都是,很多人在朋友圈晒出自家孩子的疫苗接种记录,陷入恐慌与愤怒之中。对此,官媒认为:“几乎所有的危机公关原则,都被有些部门漠视了。这才是为何昨天与今天,疫苗事件成为企业公众号、自媒体和一些谣言狂欢的温床。”;“如果再有人把责任归咎于舆论管控不力,只会吞下更多苦果,如今的局势则要求山东疾控等部门必须及时给出更有说服力的回应和更有力的行动。并非个案的疫苗事件,我们的相关职能部门必须要更“严”一点,主动以更严厉的举措加强监管、强化执行,真正充分发挥警示震慑效应,让那些利欲熏心的投机分子不敢“越雷池一步””。
(5)关于事件背后意识形态的争论
部分自由派经济学家指责政府监管不严。有自由派经济学家借口疫苗事件鼓吹完全用进口疫苗替代国产疫苗,这是舍本逐末,用远水来救近火的想法。当年抨击政府管得太多,鼓吹国企私有化、“一卖就灵”的也是他们,如今私有化卖了之后出了问题,却又将问题归咎于政府管的太少的也是他们。
2、境外媒体
疫苗事件同样引起了境外某些势力的注意,近期境外多个反华势力通过媒体向公众输送反华意识,同时恶意歪曲事实,指责中国正在压制舆论、隐瞒事实。
【美国之音】22日发表文章指出中国国内严厉压制舆论。中共宣传部门对涉及千百万人生命安危的疫苗造假问题的报道严加控制,禁止独立调查报道,并采取无所不用其极的方式管控和封杀网络信息,其中包括不加警告直接封闭账号的措施,使中国公众的不安和恐慌进一步加深,走投无路的绝望感弥漫。认为在问题疫苗销往山东的丑闻有限曝光之后,中国一个主谈育儿经验的社交媒体微信公众号《口袋育儿》旋即发表文章试图就公众介绍有关的知识,但文章迅速被中国互联网信息内容主管部门责令立即删除
【大纪元时报】抨击中国家长对制度失去信心。恶意指出过去几年,中国发生过多次疫苗丑闻。2016年,一起疫苗过期事件导致200人被逮捕。价值5.7亿元人民币的储存不当或过期的疫苗被非法出售到全国。
(三)微信公众号主要观点
【微信公众号:bridgebeijing】政府回应需接地气
在民怨沸腾时,官方除了应该第一时间回应,还应关切民生,避免“不接地气”,避免使用民众无法看懂的专业词汇。此次监管部门在回应百白破疫苗问题时,直接套用术语“效价指标不符合标准规定”。谈到涉事企业问题时,笼统称为“造假行为”,而不谈民众关心的造假详情和具体后果。监管部门查出问题疫苗本是好事,本该说明监管体系发挥了作用。如果公示语言更加通俗易懂、更加实用,这样的公示就会赢得好感和信任。
【微信号:drpei】监管问责问题
和健康相关,甚至和生死相关的产品,我们都希望它是绝对可靠,但愿望是美好的,现实总是残酷的。空难我们都不想看到,但还是会发生,更何况疫苗这样牵涉巨大利益的产业。只要有监管的漏洞,只要惩处不给力,哪怕明知道是谋财害命,也一定有人会铤而走险。
【微信号:新热点时评】进行整改能杜绝此类事件的发生
在疫苗造假的舆情中,最可怕的并不是疫苗造假本身,而是捂住盖子不让揭开。众所周知,只有掀开了盖子,只有认真地进行整改,才可能杜绝此类事件的发生。
【微信号 RUC新闻坊】呼吁媒体提供医学科普报道
针对此次疫苗案爆发出来的问题,有关部门应找到症结并在相应的监管机制上做出有效的调整,以预防此类事件的再次发生。各媒体应对此事保持持续的关注,及时提供更多与疫苗相关的医学科普报道,以提升公众对此议题的系统性认知,降低不安全感,以公正公开的原则反映民意。
【微信公众号:bingmasi63】面对疫苗乱象,监管部门应有所作为
就本次事件而言,有关方面的应急处置,似有需要进一步完善的地方。比如,问题疫苗流向何处?注射问题疫苗是否会对孩子的身体产生不利的影响?对已注射了假疫苗的孩子,是否还需要补种?对这样一些问题,有关方面应该及时实事求是地具体回应,以尽快消除疑虑。
(四)专家观点
冲击国产疫苗行业信心,国产疫苗质量不应被妖魔化。“造假”疫苗事件爆发后,媒体人接二连三发出的文章牵动着公众的神经,引发了强烈的焦虑与不安,又一场国产疫苗的信任危机拉开帷幕。医药类媒体认为:“应对公共卫生事件的历史经验告诉我们,疫苗供应保障只能依靠自身解决。无论是从国家战略的角度,还是从生物安全的角度考虑,中国的疫苗必须牢牢控制在自己手上。”;中检院生物制品检定所所长沈琦介绍:“中国已经建立起覆盖疫苗“研发—生产—流通—接种”全生命周期监管体系,市疫苗全部实行国家批签发管理,并建立了疫苗接种异常反应监测报告系统”。医药行业人士认为:“很多企业产品质量已经接近或达到国际水准,对于个别企业的违法行为不应上升到对于整个国产疫苗的妖魔化,而能够发现检验合格产品背后的生产造假,从另一方面说明了监管体系灵敏度在提升”。
科普国产疫苗与进口疫苗区别,建议按时接种。“造假”疫苗风波使国产疫苗信任度急剧降低,医药领域开始对国产与进口疫苗区别、是否应该接种疫苗等问题进行科普。典型观点有:“无论是国产疫苗还是进口疫苗,都严格按照国家食品药物管理局的要求,进行严格的上市前临床研究,生产符合GMP要求,国产和进口的同种疫苗,在质量标准、安全性和使用上没有明显的差别。”;“疫苗生产工艺得到国家有关部门的严格管理,多年实践证明国产疫苗安全、有效。接种疫苗依然是预防疾病最经济、最有效的手段,也是每个孩子享有的权利,希望广大市民能以科学的态度看待疫苗,按时带孩子进行免疫接种”。
六、舆情分析
(一)舆情点评
1、全国角度
从2010年王克勤的调查报道《山西疫苗乱象调查》,到2013年的深圳泰康乙肝疫苗事件,再到2016年的山东非法疫苗案。每隔一段时间,疫苗的生产或管理问题就会成为舆论讨论的中心,疫苗监管的漏洞,让所有人感到大为震惊。此次长生生物疫苗案,可以说激起了一个舆论持续关注的痛点。此外,本次长生生物疫苗案,涉案疫苗高达25万支,影响范围极广,受影响人数众多。该话题具有民众性,继而引发大规模的舆论声讨。
长春长生的丑闻是由监管部门主动发现的,这本应增强人们对监管的信心。但实际情况却不容乐观。百白破的问题2017年11月就被食药监总局发现,但直到8个月后,吉林有关部门才采取行动,没收了逾25万支疫苗用剩下的186支,罚款300万。无论是监管的效率还是惩罚的力度,和假疫苗所带来的可能危害相比,都显得轻如鸿毛。此外,在受众范围极广的同时,有关部门未在事件被曝光之初做出及时回应。这让公众对于多少疫苗流入市场、封存疫苗的后期处理、问题疫苗的可能影响与解决方案等问题产生大量讨论,激发了事件负面情绪的发酵。所以,虽然之前官方一直强调,国产疫苗的质量已经和进口疫苗一样,我国已建立覆盖疫苗全生命周期的监管体系,但此次事件让这种宏观层面上的安全保证已经变得难以具有说服力。
面对社会公众的焦虑声讨,这一次权威部门的舆情应对,总体也是迟缓低效的。对于一再发生的波及范围相当广泛的疫苗问题,越强调监管的周全尽力,在极具冲击力的个案面前,越显得荒诞虚假。对于长生生物疫苗案来说,有关部门应继续调查并及时公布相关的调查结果。除去明确追究相关责任人的责任问题,更应该明确回答公众对于疫苗流向的关心;对于受涉案疫苗影响的家庭,应明确给予科学有效的补偿建议,并敦促相关各部门落实补偿机制。针对此次疫苗案爆发出来的问题,有关部门应找到症结并在相应的监管机制上做出有效的调整,以预防此类事件的再次发生。各媒体应对此事保持持续的关注,及时提供更多与疫苗相关的医学科普报道,以提升公众对此议题的系统性认知,降低不安全感,以公正公开的原则反映民意。总而言之,行胜于言。相关部门应从速启动,严加惩罚责任人,完善政府监管链条,才是对舆情最好的回应。
2、安徽角度
7月23日上午,安徽省疾病预防控制中心发布了关于近期疫苗相关问题解答:涉事百白破疫苗未流入我省,全部停用长生狂犬疫苗。当日,安徽各地市相继回应疫苗情况。
长生生物疫苗事件后,安徽省食药监第一时间对安徽省承担长春长生生物科技有限责任公司冻干人用狂犬病疫苗配送业务的安徽瑞源公司进行了监督检查。企业按要求对在库尚未配送4个批次12000支的冻干人用狂犬病疫苗进行了封存。
从疫苗生产出厂到接种,会经过多次的运输和储存环节,也会经过省市县区多个监管部门的严格审查。尤其我们可以看到,此事件对卫计、疾控、食药等监管部门带来的冲击和倒逼,在重大不良事件出来后,我们要习惯仔细思考,确定每一个环节是否有明显的失实。而若我们的相关部门还不能引以为戒,还不能正视问题,直面问题,真正提升舆情处置能力,那么被问责、被口水淹没只是时间问题!
由于需要多个地方、多个部门合力应对,因此各方首先应该理解疫苗事件因何发酵至此,以免产生误判。因此,我们呼吁省市相关部门尽快回应民意,对当地违规企业展开彻底调查,以严肃的追惩重塑公信力,同时也要尽快切实探索更多的监督方式,尽快消除个案之后的普遍焦虑。
从22日晚上开始,大量政府的权威信息陆续登陆舆论场,虽然一些人出于各种原因在第一时间展现出“穷追猛打”的姿态,但那些信息还是起作用了。随着23日公安机关对长春长生立案调查的工作全面展开,事态的进一步清晰、有序一定会逐渐形成。互联网舆论事件意味着巨大压力,这种压力既是促动治理进步的正面推力,同时也会带动泥沙俱下,使一些负能量沉渣泛起。政府方面既有责任防止事态朝着消极方向发展,又应致力于将舆论事件转变成推动解决问题的契机,而后者应始终是处理舆论事件的主要方向。对于安徽,官方回应应当及时,在回应时需要注意的是,说普通老百姓能听懂的话。比如,百白破疫苗“效价指标不符合标准规定”,老百姓看了一头雾水,根本就不知道有何危害。有必要把所有专业术语都翻译成日常用语。
(二)舆情启示
1、畅通渠道疏导公众焦虑,建立疫苗安全信息交流平台
疫苗问题是关切民生之事,也是不可动摇的社会底线。目前疫苗舆情已成怒火燎原之势。正视并重视疫苗舆情,是唯一正确的选择。本次疫苗“造假”事件舆情仍在发酵,为避免信息不对称导致次生舆情再度爆发,有关部门应尽快建立对等畅通的信息交流平台,形成良好的沟通交流机制,借助媒体、意见领袖等渠道传播理性言论,疏解公众焦虑,遏制恐慌、紧张情绪的继续蔓延,这样才能有效控制舆情危机的进一步加剧。
2、加强信息宣导,引导舆论走向
社交媒体的广泛运用让舆论生态进入“后真相”时代,新闻信息碎片化、假新闻呈现病毒式传播趋势日益明显,相较于主流媒体,网民更依赖“部落化小圈子”获得信息,分享观点。长生生物疫苗“造假”事件爆发后,舆论在社交媒体上呈现裂变式传播,可能会产生群体极化和社群撕裂的状况。面对目前的舆论生态,官方应争取第一时间发布权威信息,赢得话语权,掌握主导权。政策宣导工作重点应围绕监测预防、舆情的引导以及处置等方面展开,相关部门应相互配合,及时掌握倾向性舆论,通过抢先社交媒体场域,占据舆情传播领地,挤压谣言的生存空间,提升社会认同。
3、保证处置公开透明,抑制舆情深度蔓延
目前,长生生物疫苗“造假”事件正值舆情爆发期。在相关部门启动调查程序后,作为政府宣导部门应及时公开调查程序,在尊重事实合理的基础上,全面客观向社会公布调查进展,回应公众最关切的疫苗影响范围、企业责任人、监管及如何避免此类问题再次发生等问题,消解公共舆论诉求,借助媒体力量,抑制舆情深度蔓延,重构政府形象。
4、问责政府的同时警惕新自由主义对舆论的引导
眼下一定要提防新自由主义及其境外资本金主借机调转舆论方向、鼓吹引入外资疫苗企业或者进口国外疫苗的主张,借鉴三鹿奶粉时间后中国国产乳制品长期萎靡的教训,格外提防借机呼吁中国开放疫苗市场、引入外资疫苗企业或进口疫苗的声音。
5、警惕境外反华势力恶意反扑
在疫苗事件爆发的特殊时期必须警惕境外反华势力对我国意识形态以及国家安全的反扑,在坚持舆论透明的同时,加强对境内舆论的监测和引导,删除反华势力的不利影响,警惕不利舆论的扩散。
6、传统常规的监管思维之外,尝试让多方位的监督发力
这次忙着翻看疫苗接种手册的家长,大多会惊讶于自己此前对疫苗的无知。在现实中,孩子从出生那天起,该打什么疫苗,尤其是一类疫苗,基本都已经被相关部门包办了。家长需要做的,只是在规定时间把孩子送过去,根本不会太在意打的什么疫苗,打的哪家企业的疫苗。国家包办免费提供疫苗,这本来是进步,家长愿意让渡自己的知情权,也是出于对公权力的彻底信任。但现在看来,仅靠政府部门的内部监管,很难杜绝一再发生的疫苗问题。有媒体调查发现,长春长生此前涉及多起行贿,行贿地方医院、疾病防疫部门,用给予回扣的方式推销产品。应对封闭运行中的腐败,就有必要还社会充分的知情权,发挥媒体、公众等各方的监督作用。
七、他山之石
国外在疫苗管理方面可借鉴的经验:
(一)美国:在疫苗行业的一整套严格法律
其中包括但并不限于:
在美国要求疫苗装运和疫苗到货时间间隔不应大于48小时,疫苗日常储存时冷藏室的温度应当保持在2到8°C,冷冻室的温度应当保持在零下15°C或更低,冰箱中还要放置大瓶装的水,以便冰箱打开门时内部的温度保持不变。
而以上法律的每一条又会细分成系统的行业法规,譬如在美国我经常与冷链(cold chain)运输打交道,深知它对保证疫苗等生化制品效用的重要、美国疾病控制和预防中心专门出台了法规来规范疫苗和生物制品的运输。
一旦哪个环节有违反法律法规的事件发生,不仅有案可查,而且惩罚严厉,小到罚款,大到监狱时间,上了终生不准涉足该行业的黑名单更是难以避免。
(二)德国:疫苗储存运输 如同运送生化武器
疫苗生产出来之后,就进入了储存运输这一环节。为保证疫苗的安全,德国动用了类似于运输“生化武器”的装备——“疫苗冷链”。
疫苗冷链是指,为保证疫苗从生产企业到接种单位运转过程中的质量而装备的储存、运输冷藏设施、设备。德国的疫苗专用运输车除驾驶室外,全部采用避光、密封性能好的特殊材料制成,每辆车都有防热、防静电、防辐射等功能。同时,每车还配有两名带武器的安保人员,其安全级别可以与运送“生化核武”的军车相比。运输车将疫苗运到各州的疫苗公司后,会被放入专门的疫苗仓库。仓库内的变温储藏柜可根据每种疫苗的不同需要而调整相应的温度。
(三)英国:严控疫苗生产厂商资质 全英仅7家生产商
疫苗的审批、生产是疫苗安全链条的第一环,也是至关重要的一环。对此,英国政府予以高度重视。
英国严格控制疫苗生产厂商资质。在英国药品行业协会登记的成员有64家,而其中仅7家获得了英国卫生部的疫苗生厂商资质。数量之少,原因有二:第一,英国卫生部设有专门的疫苗资质审查、管理机构。要取得生产资质,必须通过严格考核,如研制能力、生产设备、资金等。第二,英国提供全民免费医疗服务,英国卫生部是欧洲最大的疫苗采购方,每年用于采购疫苗的资金超过2亿英镑,英国民众所需的全部疫苗都由英国卫生部统一采购。由于英国卫生部是唯一的买家,垄断的购买力使其在与疫苗生产商的谈判中具有很大发言权,其签订的合同价远低于生产商公布的市场价。因此,英国上市的疫苗品种越来越多,而疫苗生产商的数量却越来越少。英国卫生部强大的定价能力让疫苗生产利润趋薄,使得许多企业退出该领域。
英国的“药品及保健品监管署”和“保健署”负责监管疫苗的安全性。英国要求包括疫苗在内的生物产品,每一批次在上市前都要进行质量和有效性检测,只有通过该检测才能获批入市。检测分两个层次,首先由生产商自测,然后由欧盟认可的几家官方药品检测实验室其中的一家再次检测。
英国很重视疫苗的供应稳定性。英国尽量避免某种疫苗只能由一家企业生产的局面,因为过分依赖一家企业将影响供应稳定性。英国曾经出现过唯一的生产商由于污染而停工,结果导致供应中断的现象。
(四)日本:不良反应监测 所有事故都上报
1996年,日本发生了一起著名的“问题乙肝疫苗”事件。当年,日本生产的乙肝疫苗中使用了艾滋病和肝炎患者的血清作为原料,导致部分接种者致病。
痛定思痛,日本政府开始对此严管管理:1、在现有的不良反应监测机构中,增加第三方医师和专家。即除厚生省、疫苗研发机构外,增加并非厚生省指定的医师和专家参与。增强社会监督,杜绝腐败;2、生产企业应报告所生产的疫苗发生的所有不良反应——“零”报告,而不采用所谓的“安全比率”,即不良反应在一定比率下不予上报的制度。
(五)加拿大:一旦疫苗出现问题 能全部追回
一旦疫苗出现质量问题,首先要做的就是召回。对此,加拿大独有的“全国联网医疗数据库”发挥了强大的作用,不仅能做到准确、迅速,而且一支也不会少。
加拿大“全国联网医疗数据库”记录有三部分内容:住院病人、门诊病人和购买处方药病人的全部信息。由于每个加拿大人(也包括非公民的永久性居民)都有独一无二的医疗卡号,因此任何一项医疗记录都能清晰找到时间、地点和责任人,无法涂改、删除,包括你在何时、何地接种了何种疫苗,都可以查得一清二楚。政府召回疫苗依靠的正是这一数据库。由于发放工作由官方进行,只需从数据库中找到相应批号疫苗所发放的范围、网店和数量,以及已接种者的姓名,就可以把所有问题疫苗一支不少地找出来。
八、有关疫苗的科普知识
下一代的健康关乎每个家庭的幸福,也关乎整个民族的命运。
接种疫苗十分必要:
疫苗本身是减毒或者灭活的病原体,注入人体内后,刺激人体免疫系统产生免疫反应,并形成记忆,一旦真正的病原体入侵,免疫系统可根据原有记忆,产生相应抗体来保护机体。目前全球仅20多种疾病有相应的疫苗,主要针对免疫能力较弱的儿童和老人。所幸的是,五岁以下儿童疾病死亡原因前7大均已有相应的疫苗。
五岁以下儿童主要疾病对应疫苗:
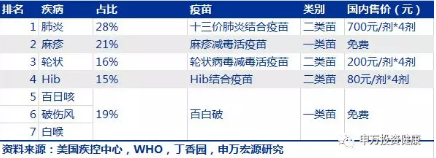
于社会群体来说,接种疫苗可减少医疗总费用支出。根据美国CDC的研究报告,2009年美国儿童基础疫苗费用约为75亿美元,但该疫苗项目节省了约688亿美元的医疗支出。对于个体来说,疫苗基本针对的都是严重感染性疾病,虽然疾病本身发病率并不高,但一旦发生,则为100%。
一类苗与二类苗
我国疫苗分类一类疫苗和二类疫苗,一类疫苗是政府免费提供,强制接种的疫苗,二类疫苗是老百姓自费、自愿接种的疫苗。一类苗无需多说,是国家挑选出的最有必要接种的疫苗,国家也会强制接种。二类苗是一类苗的有效补充,故在经济允许且无禁忌症的情况下,二类苗也建议全部接种。
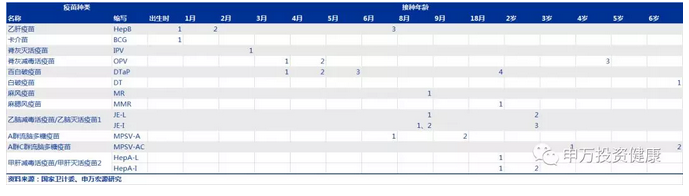
国家免疫规划疫苗儿童免疫程序表(2016年版):
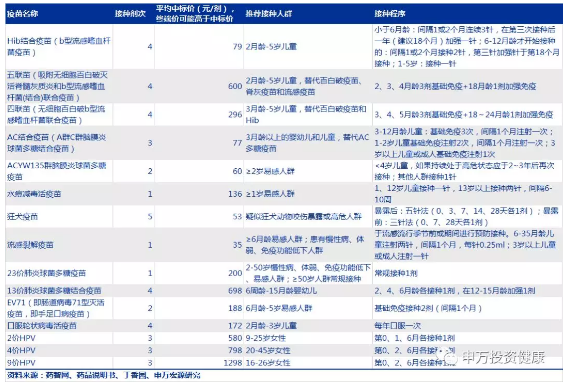
主要二类疫苗接种程序:
※ 遇到问题疫苗怎么办?
1、请家长检查疫苗接种手册,是否注射了问题批次的疫苗
根据中国疾控中心的说法,“儿童家长或监护人可以查看儿童预防接种证上的百白破疫苗接种记录,与公布的疫苗生产企业和批号进行对照,判断是否接种了相应批号的不合格百白破疫苗。也可以咨询接种单位,由接种单位协助查询所接种百白破疫苗的批号,判断是否接种了相应批号的不合格百白破疫苗。还可以拨打12320卫生热线咨询。”
2、是否补种疫苗
根据最新版本(2016版)的国家免疫计划儿童免疫程序,百白破疫苗补种应按照以下原则:
(1)3月龄~5岁未完成D(白喉)Ta(破伤风)P(百日咳)规定剂次的儿童,需补种未完成的剂次,前3剂每剂间隔≥28天,第4剂与第3剂间隔≥6个月。
(2)≥6岁接种DTaP和白破疫苗累计<3剂的儿童,用白破疫苗补齐3剂;第2剂与第1剂间隔1~2月,第3剂与第2剂间隔6~12个月。
(3)根据补种时的年龄选择疫苗种类,3月龄~5岁使用DTaP,6~11岁使用吸附白喉破伤风联合疫苗(儿童用),≥12岁使用吸附白喉破伤风联合疫苗(成人及青少年用)。
但是,补种疫苗存在一定风险,是否需要补种、到底需要怎么补种,还是需要咨询专业医生,按照目前的官方说法,“是否需要补种,仍需要一个科学的评判,目前还没有这样的结果。”
什么方法能够知道孩子接种的疫苗是否起效了呢?
这个问题应该是许多家长关心的。《全国疾病预防控制机构工作规范》中介绍了针对百白破三联疫苗,可以通过锡克氏皮试的方法检测白喉杆菌的免疫。具体方法是在被测定对象的前臂掌侧中下1/3处皮内注射0.1毫升锡克氏试验液,注射后96小时判定结果,注射部位皮肤出现≥10×10毫米的红色浸润判为阳性,表示体内对白喉无免疫力,必须重新接种。除此之外,还可以通过试管凝集试验检测百日咳疫苗、间接血球凝集试验检测破伤风疫苗的效果。对于乙肝、风疹等疫苗,由于没有较为简便的方法,可以通过检测抗体的方式进行检测。


